丙肝全球最新成果-日本首批daclatasvir+asunaprevir方案
百时美施贵宝公司7月7日发布消息称,日本卫生劳动福利部已经批准该公司出品的daclatasvir(Daklinza)+asunaprevir(Sunvepra)联合用药,用于治疗丙型肝炎病毒(HCV)基因1型感染者,其中还包括治疗那些出现代偿性肝硬化的患者。Medscape医学新闻对此消息进行了报道,现将主要内容编译如下:
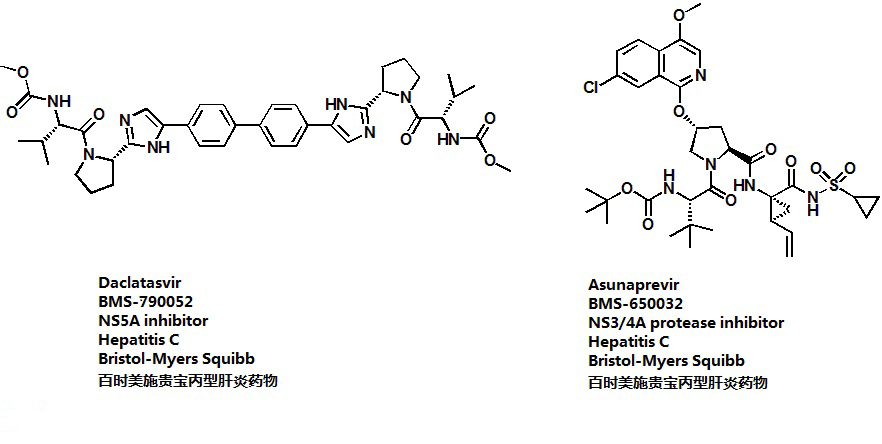
daclatasvir+asunaprevir 简介:
daclatasvir是一种强效、全基因型NS5A复制复合体抑制剂;而asunaprevir则是一种NS3/4A蛋白酶抑制剂。在日本,这两种药物组合是第一个正式批准用于治疗HCV感染的无干扰素、无利巴韦林全口服用药方案。
日本丙肝携带者中约70%感染病毒类型为HCV基因1b型。日本广岛大学Kazuaki Chayama博士表示,目前日本存在一个独特的HCV患者人群,当中许多人年龄较大、对传统治疗方法不能耐受或无应答反应。因此,现在亟需对这部分人群寻求一种有效的治疗方案。daclatasvir+asunaprevir联合用药方案获得日本官方正式批准,对于日本国内许多这样的HCV感染者而言,首次得到了一种新的用药选择。

在日本,daclatasvir+asunaprevir组合用药方案适用人群为慢性HCV基因1型感染合并或不合并代偿性肝硬化患者,这些患者不能耐受或不适用干扰素为基础的治疗方案,抑或对含干扰素治疗方案无应答反应;该用药组合旨在改善这部分人群的病毒血症情况。
真实疗效:
Chayama博士带领的研究小组对此开展一项III期临床试验。结果显示,日本HCV基因1型感染者接受daclatasvir+asunaprevir方案治疗,有84.7%的患者在治疗结束后24周达到持续病毒学应答(SVR24)。
65岁以上不能耐受或不适用干扰素方案的丙肝患者中,有91.9%的患者接受该方案治疗后达到SVR24;基线时出现代偿性肝硬化的患者中,总体达到SVR24比例为90.9%。
研究对象中仅有5%患者因为不良反应而中断治疗。其中,严重不良反应事件发生率较低(5.9%),几乎没有严重不良反应发生超过1例患者。总体来看,鼻咽炎是最常见的不良反应(30.2%)。
全球认可:
继日本卫生劳动福利部批准daclatasvir(Daklinza)+asunaprevir(Sunvepra)联合用药,美国食品和药物管理局(FDA)于2014年2月审批通过daclatasvir+asunaprevir组合方案,并将该方案认定作为突破性疗法,指定用于治疗HCV基因1b型感染。
携康国际提供专业的海外就医全程服务,融汇日本、德国顶尖治疗经验和技术,长期致力于引进国际最新科研成果,为国民健康保驾护航!免费咨询热线:400-067-0509
